鉛電池の原理・特徴
鉛蓄電池とは?
鉛を用いた二次電池の一種で、正極には酸化鉛(PbO2)、負極には海綿状鉛(Pb)、電解液に希硫酸(H2SO4)が用いられています。
公称電圧は2V/セルで、充電することで繰り返し使用できます。
自動車や産業車両、産業用などのバッテリーに幅広く用いられています。
〇放電反応:バッテリーから繋がれた電気機器に電気を供給している状態
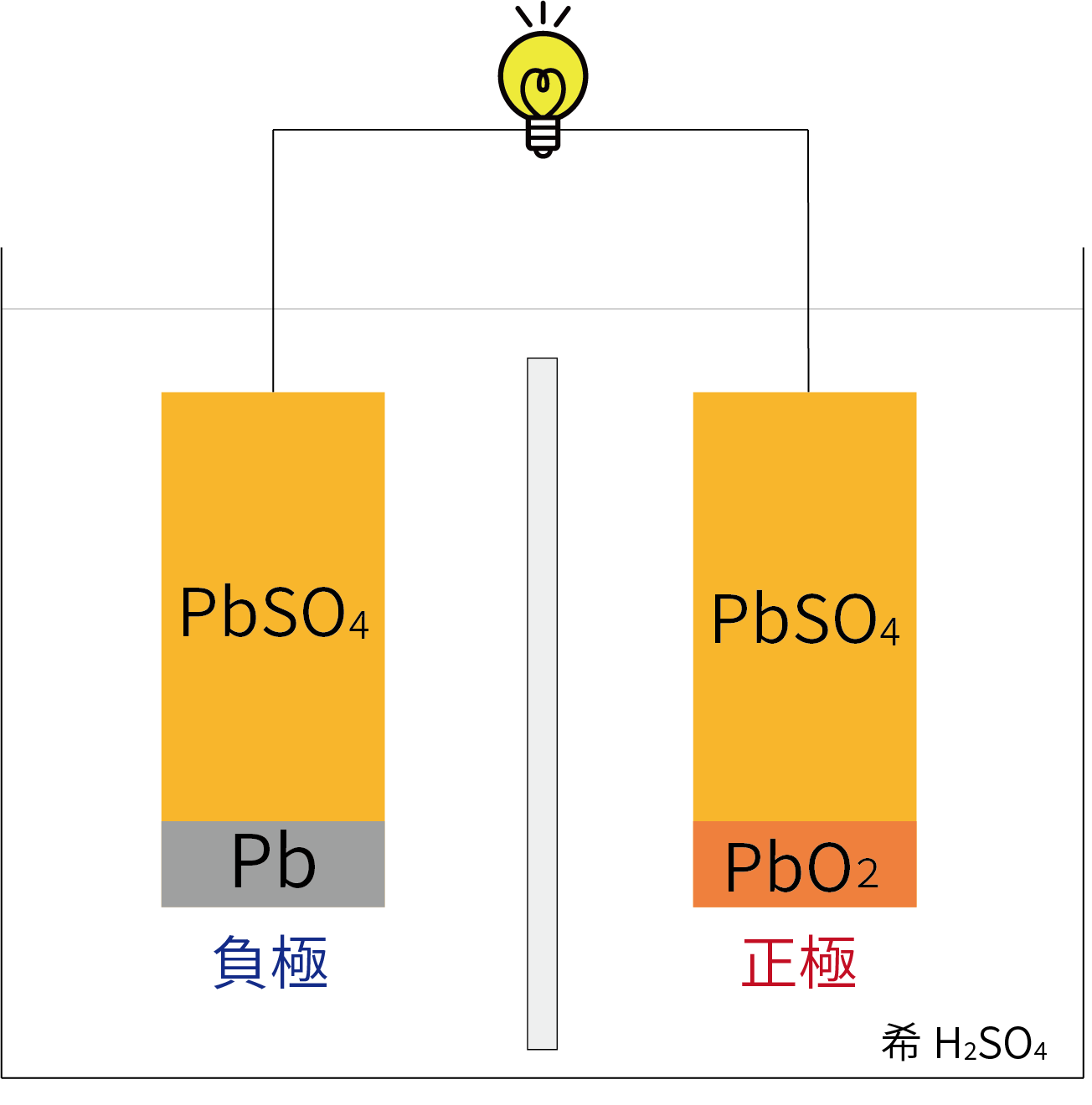
正極:PbO2+4H++SO42-+2e–→PbSO4+2H2O
負極:Pb+SO42-→PbSO4+2e–
放電により、正極・負極ともにPbSO4が生成し、H2Oも生成する(電解液の濃度が薄くなる)。
*電解液が薄くなると凍りやすくなるなど、故障の原因に!

〇充電反応:充電器などからバッテリーに電気が供給され、エネルギーを蓄えている状態

正極:PbSO4+2H2O→PbO2+4H++SO42-+2e–
負極:PbSO4+2e–→Pb+SO42-
充電によりPbSO4から正極にはPbO2、負極にはPbが生成し、H2SO4も生成する(電解液の濃度が濃くなる)。

⇒2つの反応をまとめると、蓄電池全体で
PbO2+2H2SO4+Pb←→2PbSO4+2H2Oの反応が起こっています。
*制御弁式鉛蓄電池の密閉の原理
制御弁式据置鉛蓄電池は車載用鉛蓄電池のような液式の鉛蓄電池とは異なり、電極とセパレータに電解液を含侵させた構造になっています。
充電時に正極板から発生するO2ガスを負極板で吸収させ、正極で失われたH2Oを再生することで、液減りを抑えています。
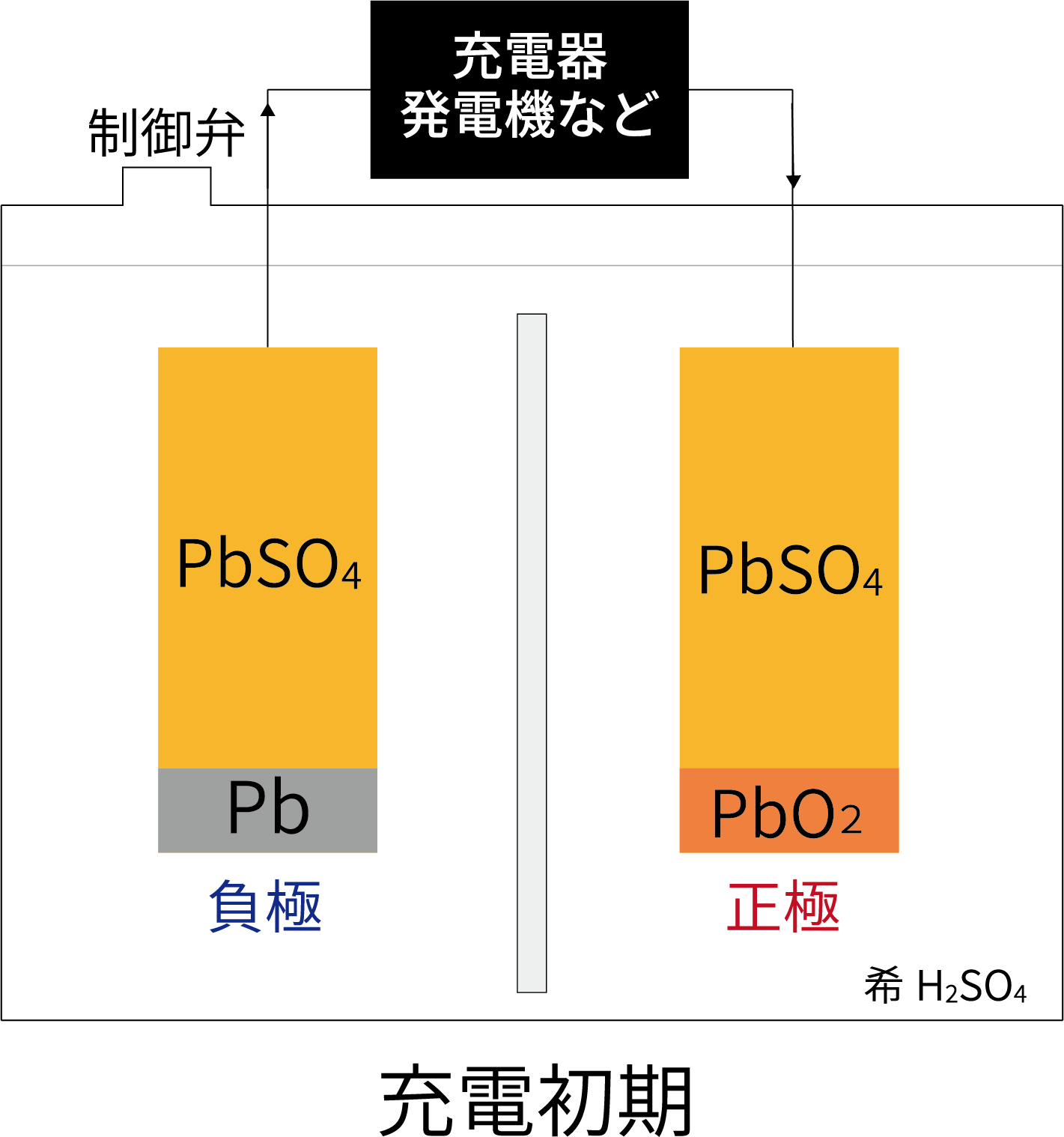
放電状態のため、正極・負極ともに極板内にPbSO4が多量に存在する。

充電によって、正極はPbO2、負極はPbに変化する。
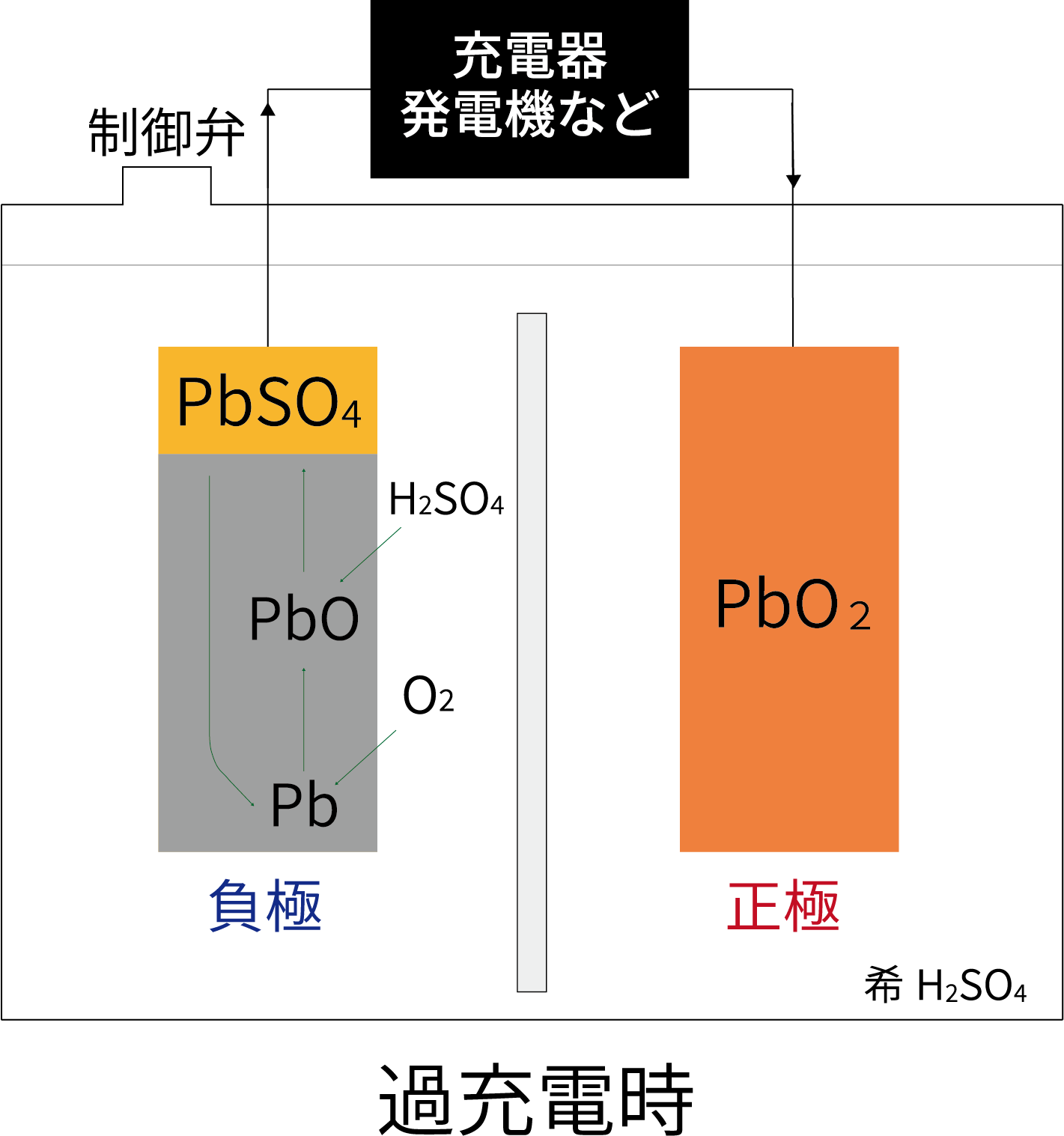
充電終期に、正極からO2ガスが発生。
O2ガスは負極のPbと反応し、PbOを生成するが、直ちにH2SO4と反応して、PbSO4とH2Oを生成する。
生成したPbSO4は、充電によりPbに戻る。
⇒上記の反応を式で表すと、
正極:H2O→1/2O2+2H++2e– 負極:Pb+1/2O2+H2SO4+2H+→PbSO4+H2O
PbSO4+2H++2e–→Pb+H2SO4